L'Influenza Aviaire (IA), souvent désignée sous le terme de Grippe Aviaire, est une maladie d'origine virale qui représente une menace persistante pour la santé animale et la sécurité sanitaire mondiale. Les études sur ce virus sont cruciales en raison de sa capacité évolutive, de sa transmission zoonotique potentielle et des répercussions économiques majeures, notamment dans le secteur avicole.
I. Étiologie et Pathogénie
A. Étiologie et Classification
L'IA est causée par des virus de l'Influenza de Type A, qui appartiennent à la famille des Orthomyxoviridae. Ces virus possèdent un ARN simple brin négatif segmenté en huit segments. Cette structure segmentée confère au virus une capacité significative de réassortiment génétique, un mécanisme essentiel à l'émergence de nouveaux variants potentiellement pandémiques.
La classification des sous-types viraux repose sur les propriétés antigéniques de leurs deux glycoprotéines de surface majeures : l'Hémagglutinine (HA) (18 sous-types) et la Neuraminidase (NA) (11 sous types). Les souches IA sont identifiées par une nomenclature incluant le type de virus, l'espèce hôte, l'origine géographique, l'année d'isolement et la description antigénique du sous-type (HA/NA).
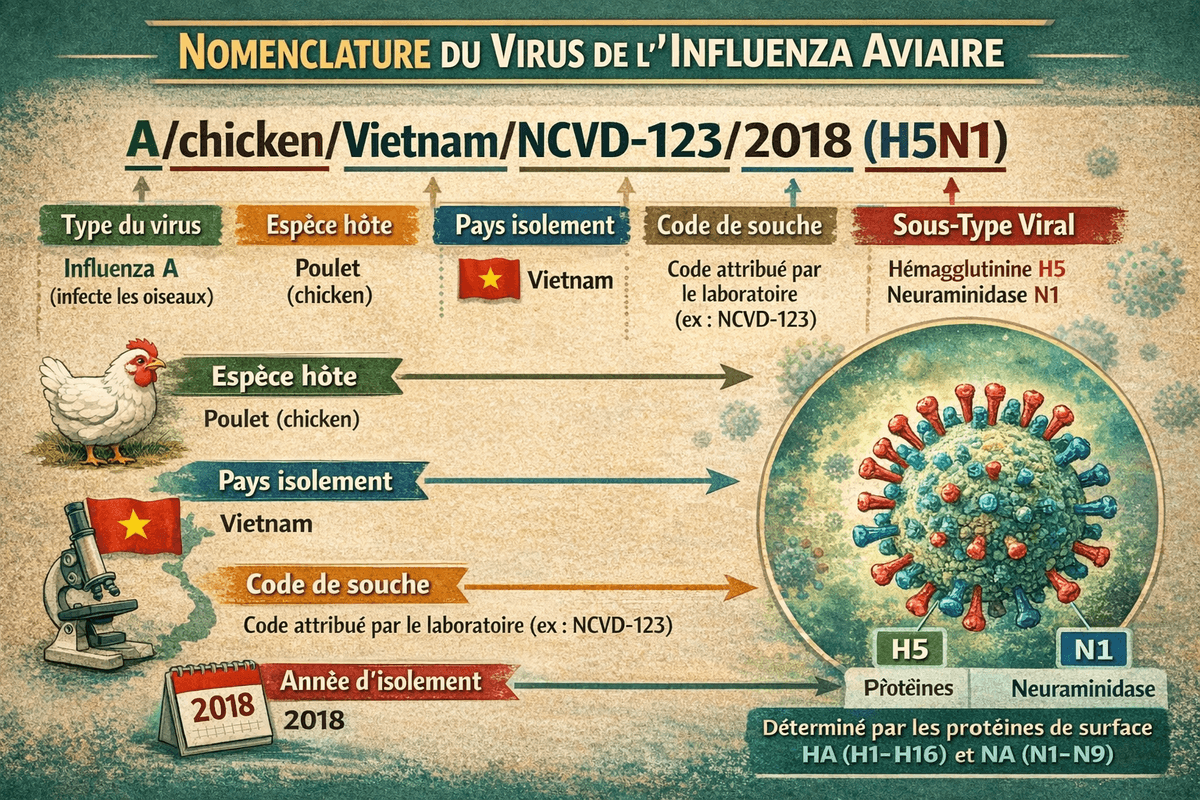
B. Déterminants de la Virulence et Adaptation Moléculaire
Le virus de l'Influenza Aviaire est classé comme Faiblement Pathogène (IAFP) ou Hautement Pathogène (IAHP). Le caractère IAHP est principalement déterminé par la structure moléculaire du site de clivage de l'Hémagglutinine (HACS).
1. Mécanisme de Pathogénicité (IAHP) : Les virus IAHP (H5 et H7) possèdent un motif polybasique (pHACS), souvent riche en Arginine (R) et Lysine (K). Ce motif permet l'activation du virus par des protéases ubiquitaires (comme la Furine), conférant au virus un tropisme pantrope (multi-organique). Ce tropisme ubiquitaire entraîne une maladie systémique grave et une mortalité rapide. En revanche, l'IAFP a un site monobasique clivé uniquement par des protéases localisées (comme la tryptase) dans les épithéliums respiratoires et digestifs, limitant la propagation. Ce tropisme limité crée une infection localisée.
2. Adaptation aux Mammifères : Le passage à un virus transmissible entre mammifères nécessite l'accumulation de mutations spécifiques, en particulier dans la polymérase et l'hémagglutinine.
◦Protéine PB2 : La mutation PB2-E627K (acide glutamique remplacé par lysine au résidu 627) est critique, car elle facilite la réplication du virus aviaire dans les cellules mammaliennes, un effet particulièrement marqué à 33°C, la température des voies respiratoires supérieures.
◦Hémagglutinine : La transmissibilité par aérosol chez les mammifères est conditionnée par l'acquisition de mutation qui confèrent une double affinité pour les récepteurs de type humain et aviaire.
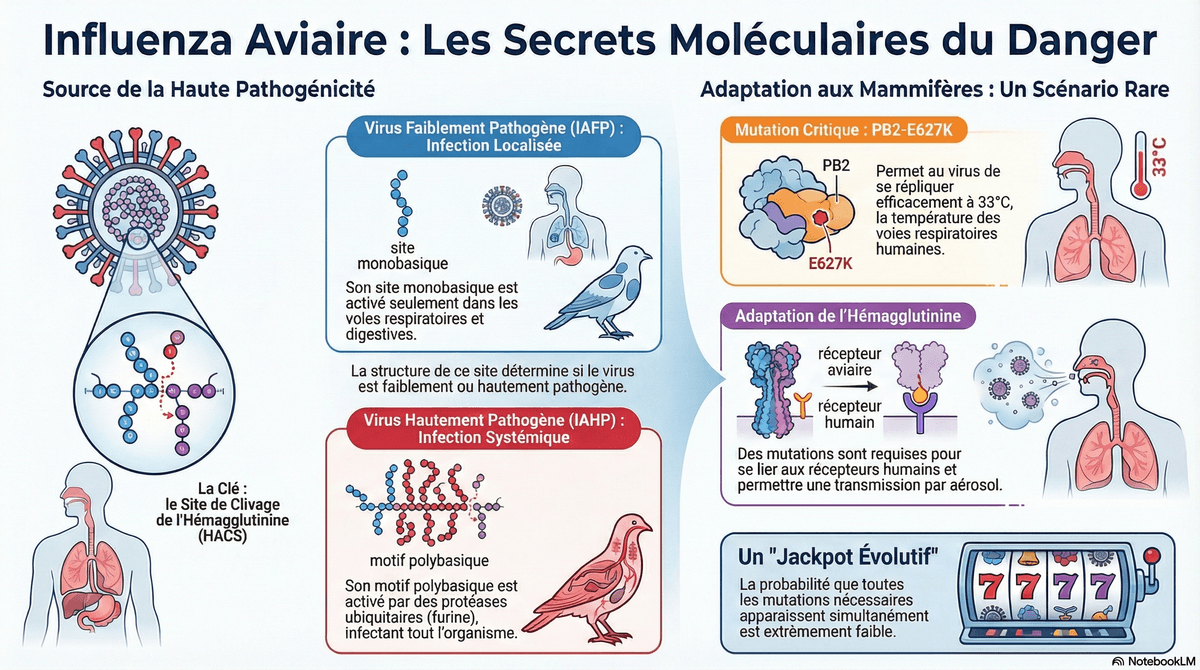
3. Contraintes Évolutives : L'émergence d'un virus transmissible entre humains est un événement hautement contraint par des facteurs tels que la sélection naturelle, la purification de la sélection et des goulots d'étranglement de transmission très étroits. Pour un virus comme H7N9, la probabilité d’acquérir simultanément l’ensemble des mutations nécessaires à une transmission interhumaine efficace lors d’infections humaines sporadiques est extrêmement faible. Une telle émergence relèverait donc d’un événement évolutif exceptionnel et imprévisible, qualifié de « jackpot évolutif ». La stratégie actuelle repose sur la surveillance active et la vaccination pré-pandémique.
II. Épidémiologie
A. Réservoirs etPropagation Mondiale
Le réservoir naturel des virus IA est constitué par les oiseaux aquatiques sauvages, principalement des ordres Ansériformes et Charadriiformes. Ces oiseaux migrateurs jouent un rôle clé dans la propagation intercontinentale des panzooties, notamment la lignée H5N1.
La maladie IAHP H5N1 a causé une propagation sans précédent en Europe et en Afrique depuis la fin de 2003, avec des foyers documentés dans près de 50 pays en 2006. Des virus comme le H5N8 se sont également répandus mondialement.
B. Transmission Inter-espèces et Zoonose
1. Transmission aux Mammifères : Les volailles domestiques sont des hôtes intermédiaires permettant le passage du virus aux mammifères. Le virus a étendu son tropisme pour infecter des espèces non historiquement réceptives, y compris des félidés,le bétail, les porcs et les visons. Les porcs sont souvent considérés comme des hôtes potentiels de brassage génétique (mixing vessel) où les réassortiments entre virus aviaires et humains peuvent se produire. En effet, les porcs possèdent à la fois des récepteurs de type humain et aviaire pour le virus de l’influenza.
2. Infections Humaines : L'infection humaine par H5N1 est rare mais a un taux de létalité élevé (environ 52% des cas recensés mondialement depuis 2003). L'exposition se produit généralement par contact étroit avec des animaux ou des produits infectés.
3. Transmission entre Élevages : En plus de la transmission directe, le virus se propage via des voies indirectes : les fomites, les véhicules (camions d'abattage, de livraison d'aliments), le matériel partagé, et le personnel (techniciens, vétérinaires) agissant comme vecteurs passifs. La transmission est particulièrement efficace entre les élevages intégrés d'une même organisation de production. Le virus de l’Influenza aviaire peut survivre jusqu’à 48 h sur les surfaces en métal, plastique et verre. Sur le sol et la litière, le virus peut survivre plusieurs semaines. Les températures élevées (+37 degrés Celsius) inactivent le virus en quelques heures.
III. Signes Cliniques et Lésions
Les manifestations cliniques varient considérablement en fonction de la souche et de l'hôte.
A. Chez les Volailles
• IAFP (Faiblement Pathogène) : Les symptômes sont généralement bénins : toux, éternuements, écoulement nasal, apathie, et baisse de la production d’œufs, avec une faible mortalité. Des lésions comme l'inflammation de la trachée et des anomalies de la coquille des œufs peuvent être observées.
• IAHP (Hautement Pathogène) : L'infection est souvent sévère avec une mortalité accrue, atteignant parfois 75% ou plus, et peut survenir brusquement. Les signes incluent la prostration, l'anorexie, l'œdème de la tête, la cyanose de la crête et des barbillons, et des troubles nerveux.
B. Lésions Anatomo-Pathologiques
Les souches IAHP H5N1 provoquent des lésions macroscopiques systémiques. Les observations post-mortem courantes chez les Galliformes et Ansériformes naturellement infectés incluent la nécrose du foie et du pancréas. Des lésions vasculaires (pétéchies et hémorragies) sont également fréquentes dans les organes internes.
C. Chez l'Homme (Zoonose)
Le tableau clinique du H5N1 varie de symptômes bénins de type grippal à une infection grave. Les cas graves peuvent se compliquer en pneumonie virale sévère. Des cas récents chez des employés de fermes laitières aux États-Unis ont inclus des conjonctivites hémorragiques.

IV. Diagnostic
Le diagnostic repose sur des tests de laboratoire car les signes cliniques ne sont pas spécifiques.
1. Prélèvements : Les échantillons de choix sur les oiseaux vivants sont les écouvillons cloacaux et oropharyngés. Pour les oiseaux morts, des écouvillons peuvent également être réalisés sur différents organes (poumons, rate, pancréas, etc.).
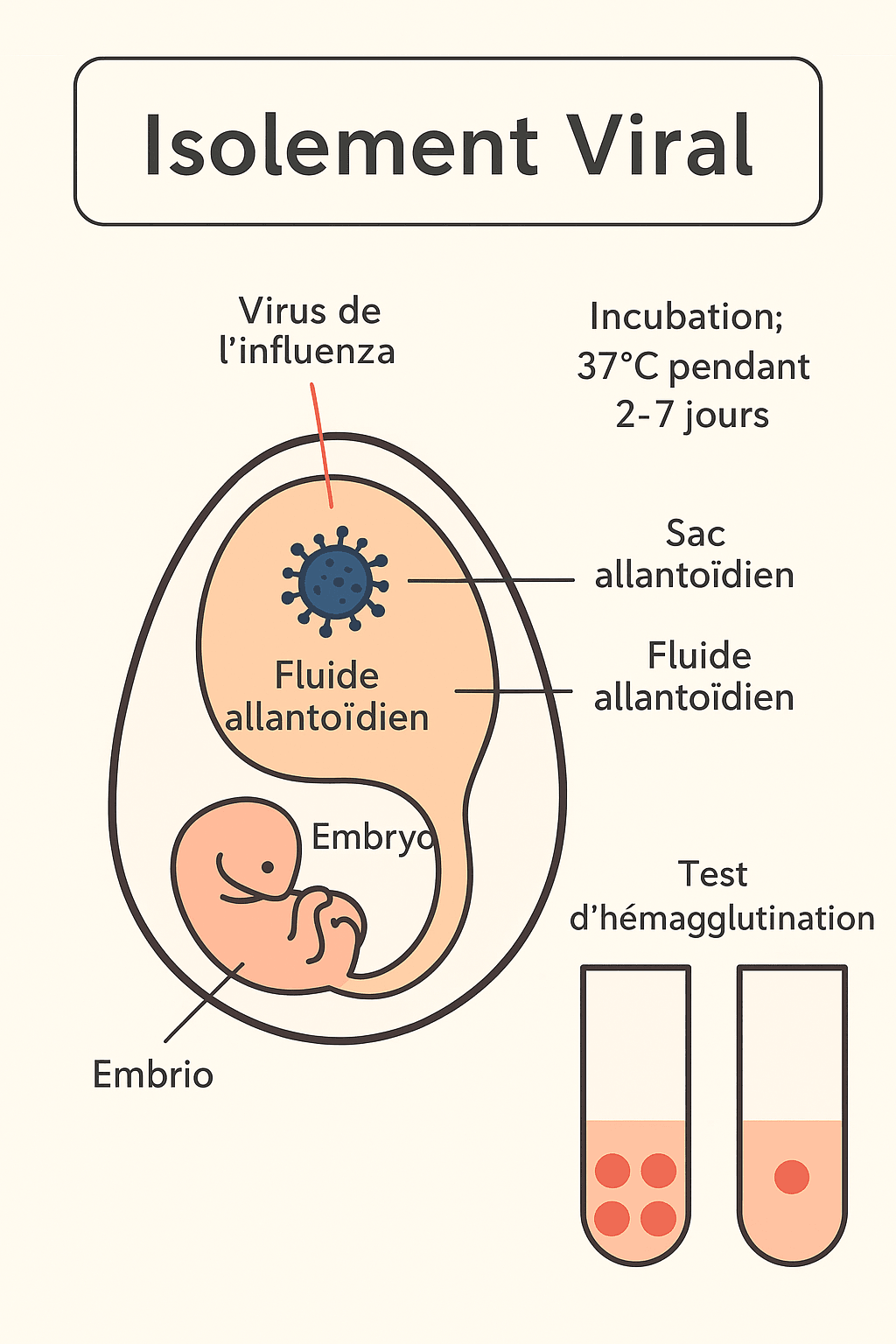
2. Isolement Viral : La méthode de référence est l'isolement du virus dans le sac allantoïdien d'œufs de poule embryonnés suivi d’une incubation à 37 degrés Celsius pendant 2 à 7 jours. Le fluide allantoïdien est ensuite soumis à des tests d'hémagglutination.
3. Méthodes Moléculaires : La RT-PCR quantitative (RT-qPCR) est la méthode de choix pour la détection rapide de l'ARN viral (gène M). Le séquençage permet de déterminer le sous-type et, pour H5/H7, de vérifier la séquence du site de clivage (motif polybasique) pour confirmer le caractère hautement pathogène.
4. Sérologie : Les tests ELISA et les tests d'inhibition de l'hémagglutination (IHA) sont utilisés pour la détection des anticorps dans le cadre de la surveillance de routine, notamment post-vaccinale.
V. Traitement
A. Pas de Traitement chez les Animaux
Il n’existe actuellement aucun traitement antiviral homologué ou recommandé pour les volailles. La gestion des IAHP repose sur l'application stricte des mesures de biosécurité et l'abattage sanitaire rapide des animaux infectés ou exposés.
B. Traitement et Prophylaxie chez l'Homme
Le traitement et la chimioprophylaxie de l'IAHP chez l'homme reposent sur les inhibiteurs de la Neuraminidase (NAI), comme l'Oseltamivir, le Zanamivir et le Peramivir. L'Oseltamivir est le traitement de première ligne recommandé.
1. Efficacité et Délai : Pour être efficace, le traitement doit être administré le plus rapidement possible, idéalement dans les 48 heures suivant l'apparition des symptômes, réduisant la durée d'excrétion virale et la probabilité de progression vers des formes graves.
2. Résistance Antivirale : L'émergence de résistance est une préoccupation majeure. Des mutations spécifiques dans le gène NA, telles que N295S et T438N, ont été détectées dans les isolats H5N1 de 2022 et ont entraîné une sensibilité réduite aux inhibiteurs de la Neuraminidase.
VI. Prophylaxie et Contrôle Sanitaire
A. Mesures Sanitaires et Biosécurité
L'IA est une maladie à déclaration obligatoire. La prophylaxie repose sur :
• Abattage et Restriction de Mouvement : L'abattage des troupeaux infectés est souvent indispensable pour éradiquer l'IAHP. Après l'abattage, des restrictions de mouvement sont imposées dans un rayon de 3 km autour du foyer, avec une surveillance renforcée jusqu'à 10 km.
• Biosécurité Renforcée : Des mesures strictes sont nécessaires pour prévenir l'introduction du virus par l'avifaune sauvage, ainsi que par les mouvements humains et de matériel. L'inefficacité des mesures de biosécurité est souvent directement impliquée dans la propagation du virus lors d'épizooties.
B. Vaccination des Volailles
La vaccination est un outil stratégique complémentaire de plus en plus utilisé, surtout dans les pays où la maladie est endémique.
1. Stratégies et Efficacité : La vaccination confère une protection en réduisant la mortalité et l'excrétion virale, mais n'empêche pas toujours totalement l'excrétion, ce qui nécessite une surveillance moléculaire intensive pour détecter l'évolution "masquée" du virus. Les stratégies les plus efficientes (meilleur rapport coût-bénéfice) couvrent le plus grand nombre d'espèces et de types de production.
2. Types de Vaccins et Application : Les vaccins peuvent être inactivés (appliqués en élevage) ou recombinants (souvent appliqués au couvoir). L'efficacité des vaccins est influencée par l'espèce, la race et l'âge de l'oiseau.
3. Stratégie DIVA : Le concept DIVA (Differentiating Infected from Vaccinated Animals) est essentiel pour le commerce international. Il permet de distinguer sérologiquement les animaux vaccinés des animaux infectés par le virus sauvage, souvent en utilisant des vaccins marqueurs qui omettent un antigène non essentiel (comme la NA ou une protéine interne).
La constitution génomique du virus de l’influenza aviaire comporte un risque élevé de mutations génétiques. L’apparition de virus mutants adaptés aux récepteurs humains et capables de se répliquer dans ce nouvel hôte pourrait être à l’origine d’une pandémie sans commune mesure. Il est primordial de mettre en place une surveillance rigoureuse et de développer des vaccins recombinants pour une réponse précoce à tout évènement épidémique impliquant le virus de l’influenza aviaire.
Références
1. NEUMANN G., KAWAOKA Y. (2019). Predicting the Next Influenza Pandemics. The Journal of infectious diseases, 219 (Suppl_1),S14 – S20.
2. IMAI M. et al. (2017). A Highly Pathogenic AvianH7N9 Influenza Virus Isolated from A Human Is Lethal in Some Ferrets Infected via Respiratory Droplets. Cell host & microbe, 22(5), 615 – 626.e8.
3. NEUMANN G., KAWAOKA Y. (2019). Predicting the NextInfluenza Pandemics. The Journal of infectious diseases, 219(Suppl_1),S14 – S20.
4. RICHARD M. et al. (2013). Limited airborne transmission of H7N9 influenza A virus between ferrets. Nature,501(7468), 560 – 563.
5. RUSSELL C.A. et al. (2012). The potential for respiratory droplet transmissible A/H5N1 influenza virus to evolve in a mammalian host. Science, 336(6088), 1541 – 1547.
6. STEEL J. et al. (2009). Transmission of influenza virus in a mammalian host is increased by PB2 amino acids 627K or 627E/701N. PLoSpathogens, 5(1), e1000252.
7. WATANABE T. et al. (2013). Characterization of H7N9 influenza A viruses isolated from humans. Nature, 501(7468), 551 – 555.
8. ZARAKET H. et al. (2015). Mammalian adaptation of influenza A (H7N9) virus is limited by a narrow genetic bottleneck. Nature communications, 6, 6553.
9. REPERANT L.A., GRENFELL B.T., OSTERHAUS A.D.(2015). Quantifying the risk of pandemic influenza virus evolution by mutation and re-assortment. Vaccine, 33(49), 6955–6966.
10. ABDELWHAB E.M., METTENLEITER T.C. (2023). Zoonotic animal influenza virus and potential mixing vessel hosts. Viruses,15(4), 980.
